Vous êtes ici
Les organoïdes : de mini-organes aux maxi-pouvoirs

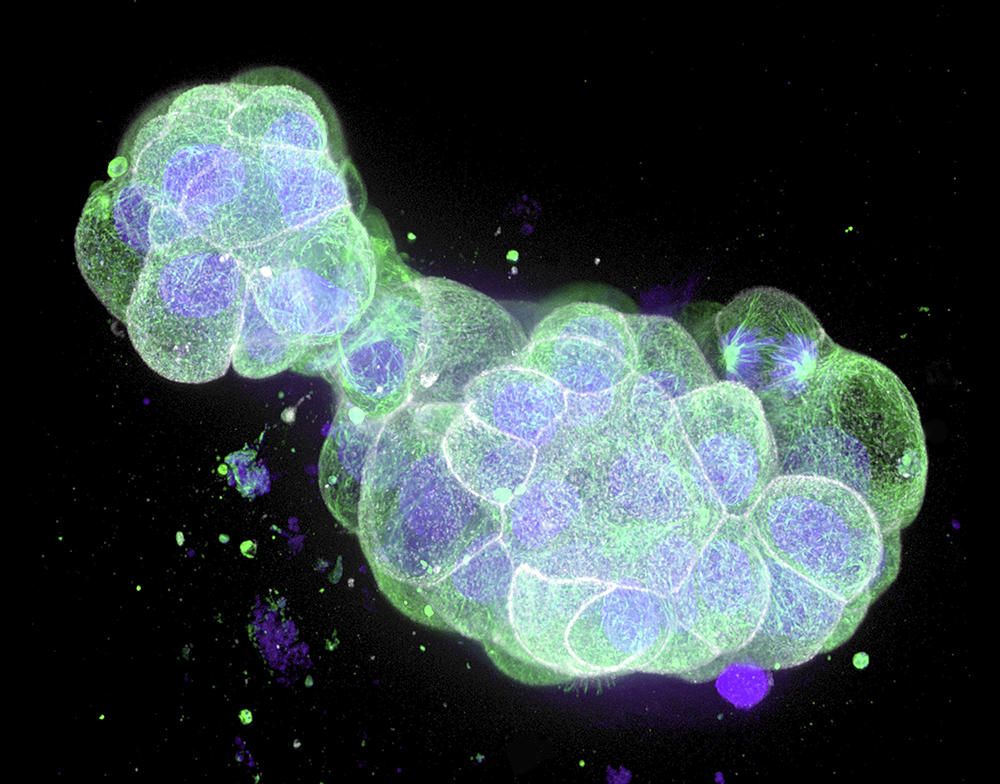
Faire pousser in vitro des copies miniatures de foie, d’intestin, de cœur, de pancréas, de rein, de poumon, de prostate, de glandes mammaires et même de cerveau. Non, cela n’est pas de la science-fiction. Ces dernières années en effet, les biologistes parviennent à créer en laboratoire tous ces mini-organes – et bien d’autres, la liste s’allongeant régulièrement. Ces organoïdes, comme ils les ont baptisés, qui mesurent à peine quelques millimètres pour les plus gros, possèdent une structure en trois dimensions qui ressemble à celle de l’organe entier – ou une partie de ce dernier – et reproduisent certaines de ses fonctions. Une telle fidélité ouvre d’alléchantes perspectives en recherche et en médecine : grâce à ces mini-modèles, on espère mieux comprendre le développement des organes et des maladies qui les touchent, évaluer l’efficacité de nouveaux traitements, voire améliorer la transplantation de cellules ou d’organes.
Isoler les cellules souches
Mais quelle est la recette pour obtenir des organoïdes ? L’ingrédient principal, ce sont les cellules souches, dont la particularité est de proliférer par division et de pouvoir se spécialiser en n’importe quel type cellulaire (neurones, cellules musculaires, cellules du foie, etc.).
Deux types de cellules souches sont utilisés. D’abord celles présentes naturellement dans certains organes, tels les poumons ou l’intestin.
« Dans ces organes, les cellules souches se divisent constamment pour renouveler les tissus – en quelques jours pour l’intestin – et les réparer en cas de lésion. C’est ce phénomène que nous mettons à profit en laboratoire pour fabriquer des organoïdes », explique Céline Cougoule, de l’Institut de pharmacologie et biologie structurale1. C’est ainsi qu’en 2009, les premiers organoïdes d’intestin ont été créés par des chercheurs hollandais.
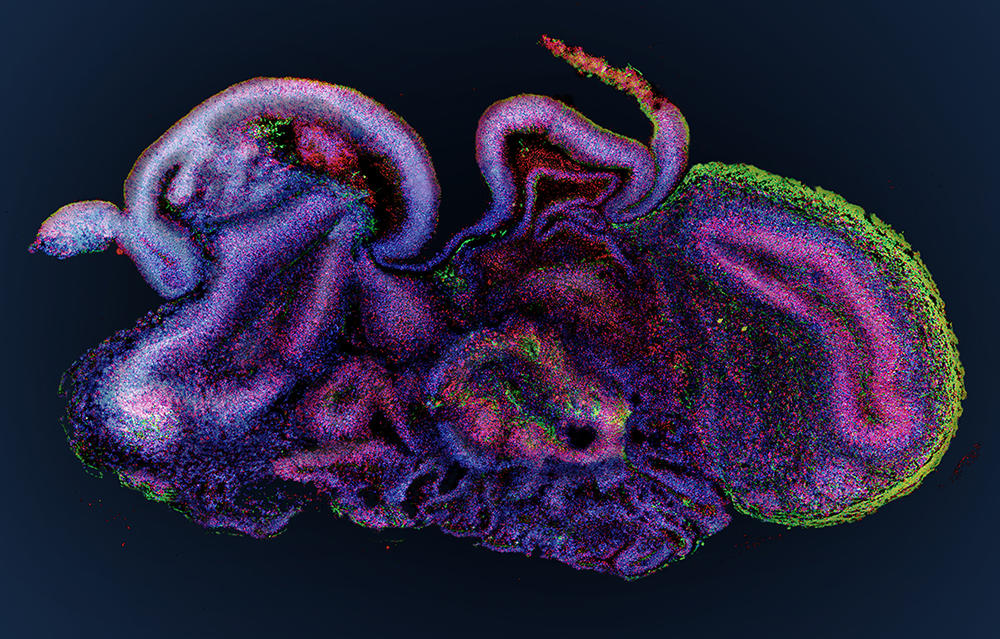
Les organoïdes peuvent aussi être engendrés à partir de cellules souches dites « induites » (ou iPS). Ce sont des cellules adultes différenciées qui ont été reprogrammées génétiquement à l’état de cellules souches. Cette technique a révolutionné le domaine des organoïdes par sa simplicité de mise en œuvre – les cellules adultes sont prélevées dans la peau ou le sang d’une personne – et aussi parce qu’elle permet de s’affranchir de l’utilisation, controversée, de cellules souches d’embryon. C’est de cette manière qu’on obtient notamment des organoïdes de cerveau (cérébroïdes) ou encore de rétine.
Cultiver une réplique 3D miniature
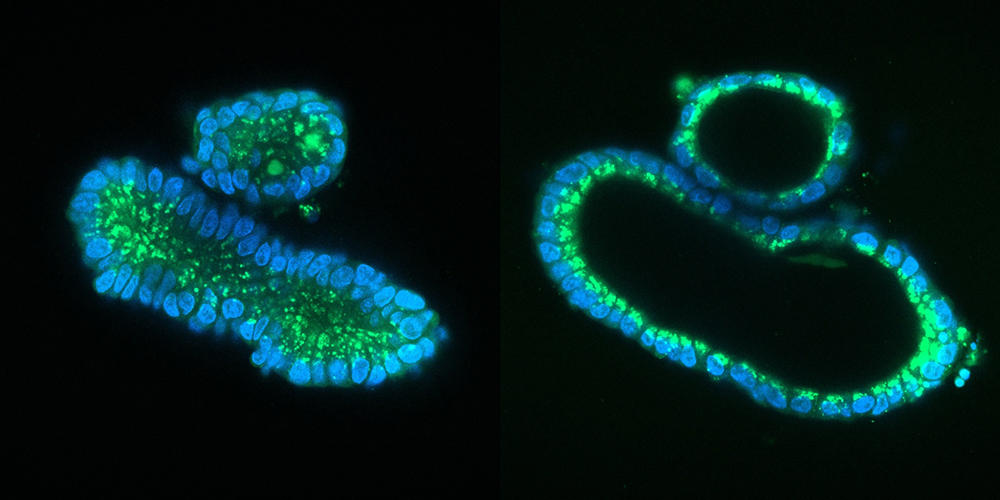
Une fois les cellules souches isolées, celles-ci sont placées dans un gel nutritif, une matrice qui leur permet de croître en 3D : en ajoutant à ce milieu de culture un cocktail de substances qui stimulent la différenciation des cellules, celles-ci se spécialisent et s’organisent spontanément en une structure tridimensionnelle qui réplique l’architecture du tissu ou de l’organe en question, en possédant la même variété de types cellulaires. Cette méthode, qui récapitule les mêmes processus que lors de la formation d’un embryon, permet d’obtenir un organoïde suffisamment mature en une semaine pour un intestinoïde, voire quelques mois pour un cérébroïde.
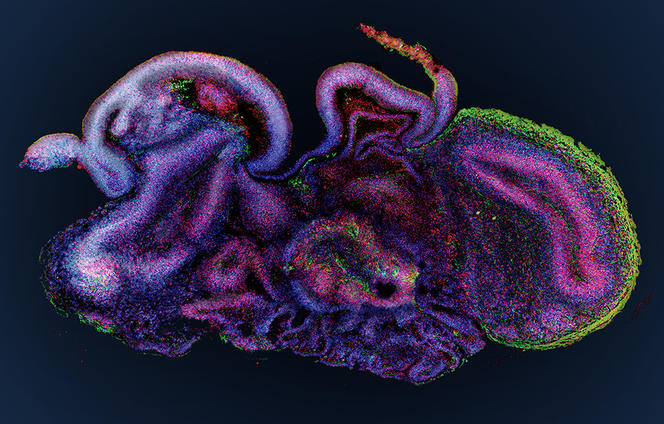
Par rapport aux cultures cellulaires traditionnelles effectuées à plat au fond d’une boîte de Petri, les organoïdes changent complètement la donne. Leur structure en 3D, combinée au fait qu’ils mélangent plusieurs types de cellules qui peuvent interagir entre elles comme dans un véritable organe, fait qu’ils miment beaucoup mieux le fonctionnement de ce dernier. Et reproduisent certaines de ses fonctions majeures : par exemple des fonctions de sécrétion et d’absorption pour un intestinoïde et même une activité électrique pour un cérébroïde, comme l’a montré une équipe américaine en 2019.
Comparés aux modèles animaux utilisés par les biologistes, les organoïdes représentent également une avancée majeure. « Comme ils sont obtenus à partir de matériel humain, ils sont plus prédictifs de la façon dont se développe une maladie chez l’homme, ou de sa réponse à une infection ou encore à des traitements médicamenteux », souligne Jean-Luc Galzi, directeur de l’infrastructure du CNRS ChemBioFrance.
On comprend alors pourquoi si, au départ, ces organes miniatures ont été conçus pour étudier les processus à l’œuvre lors du développement de nos organes – difficilement accessibles à l’observation in vivo –, ils permettent désormais d’envisager de nombreuses applications sur le plan thérapeutique.
Décrypter les maladies
Les organoïdes constituent tout d’abord un formidable matériau vivant pour décrypter les maladies. En effet, comme ils peuvent être créés à partir de cellules souches provenant de malades, ces agrégats en 3D reproduisent les anomalies tissulaires des patients. Ce qui permet de mieux comprendre les mécanismes moléculaires ou cellulaires à l’origine des pathologies. Et de tester des solutions thérapeutiques, avec le postulat que ce qui fonctionne pour « soigner » la copie de l’organe aura de bonnes chances de fonctionner aussi dans l’organisme du malade.
Cette approche est particulièrement vraie pour les maladies génétiques : les cellules qui constituent les organoïdes sont porteuses des mêmes mutations responsables de la maladie que celles présentes dans les cellules des patients et présentent alors les mêmes dysfonctionnements qu’on peut étudier à la loupe. Ces avancées ont déjà permis de soigner des patients atteints de mucoviscidose, une maladie héréditaire qui touche les voies respiratoires et digestives et qui se traduit entre autres par une production excessive de mucus. En cause dans cette maladie : les mutations du gène CFTR qui affectent une protéine située à la surface des cellules, réduisant le transport d’eau et de sel à travers leur membrane.
Il existe aujourd’hui des médicaments qui améliorent le fonctionnement de cette protéine. Mais la plupart du temps, ces molécules sont développées et testées chez des patients présentant les mutations les plus fréquentes de la maladie, laissant de côté ceux porteurs de mutations plus rares.

C’est là que les organoïdes entrent en jeu : depuis 2015, des chercheurs hollandais font pousser des copies d’intestins dérivées de cellules de la muqueuse rectale prélevées sur ces patients. Ils peuvent alors tester sur ces structures cellulaires l’efficacité des médicaments – en déterminant si la fonction du gène est restaurée. En cas de succès, la molécule peut alors être prescrite aux patients. « Cette médecine personnalisée, rendue possible par les organoïdes, n’en est qu’à ses débuts mais elle promet de changer la vie des malades dans le futur », se réjouit Céline Cougoule.
Comprendre les maladies intestinales chroniques
Et bien d’autres maladies bénéficieront bientôt de l’apport des organoïdes, qui sont mis à contribution dans les laboratoires du monde entier. En France, où près d’une centaine de laboratoires sont impliqués dans ce nouveau champ de recherche, de nombreux organes disposent désormais de leur réplique in vitro. À l’Institut de recherche en santé digestive de Toulouse, Nathalie Vergnolle, Audrey Ferrand et leur équipe développent des organoïdes de côlon. Objectif : mieux comprendre les processus cellulaires en jeu dans deux maladies inflammatoires chroniques intestinales, la maladie de Crohn et la rectocolite hémorragique, ainsi que dans la polypose adénomateuse familiale, maladie génétique où apparaissent de nombreux polypes dans le côlon des personnes touchées et qui peut conduire à un cancer colorectal.
« En comparant des cultures de tissus sains et malades, nous avons identifié les mécanismes impliqués dans le défaut de régénération des tissus pour ces maladies inflammatoires, et nous avons observé un lien entre cette maladie génétique et un facteur de croissance. L’étape suivante sera de rechercher des molécules capables de stimuler la régénération dans le premier cas et d’inhiber l’action de ce facteur de croissance dans l’autre cas, de manière à “réparer” nos organoïdes. Avec la possibilité ensuite d’en faire des traitements pour les malades », confie Audrey Ferrand.
Lutter contre les infections pulmonaires
De son côté, Céline Cougoule fabrique des organoïdes de poumon qui sont ensuite infectés par micro-injection de virus ou de bactéries. Avec son équipe, elle observe ensuite la réponse des cellules à l’infection. Dans le cas de la mucoviscidose – où, du fait de l’accumulation de mucus, les poumons sont le siège d’infections bactériennes qui constituent la première cause de mortalité des malades – les chercheurs ont montré qu’en présence de certaines bactéries, Mycobacterium abcessus, les organoïdes issus de patients exhibaient un stress oxydatif très fort.
« En traitant nos organoïdes avec des antioxydants, nous avons fait baisser significativement ce stress et lutter ainsi contre l’infection2. À terme, cela pourrait conduire à la mise au point d’un traitement complémentaire aux antibiotiques, contre lesquels ces bactéries développent des résistances », s’enthousiasme la biologiste. Autres travaux importants : depuis le début de l’épidémie de Covid-19, l’équipe se sert d’organoïdes de poumon infectés par le Sars-CoV-2 pour tester des médicaments déjà utilisés pour d’autres pathologies. Une fois une molécule administrée à leurs mini-organes, les chercheurs mesurent son effet sur la réplication du virus.
Céline Cougoule a pu ainsi montrer l’action antivirale et anti-inflammatoire de la fluoxétine, utilisée habituellement comme antidépresseur, dont une étude sur des patients avait permis au préalable de pointer un effet protecteur contre le Covid3. « Les organoïdes sont en train de s’imposer comme un outil indispensable pour les tests précliniques et ainsi comme une alternative pour réduire l’expérimentation animale », souligne la chercheuse.
Déchiffrer les causes des maladies neurodégénératives
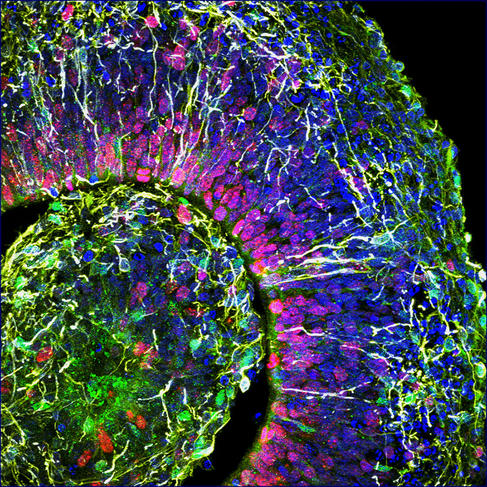
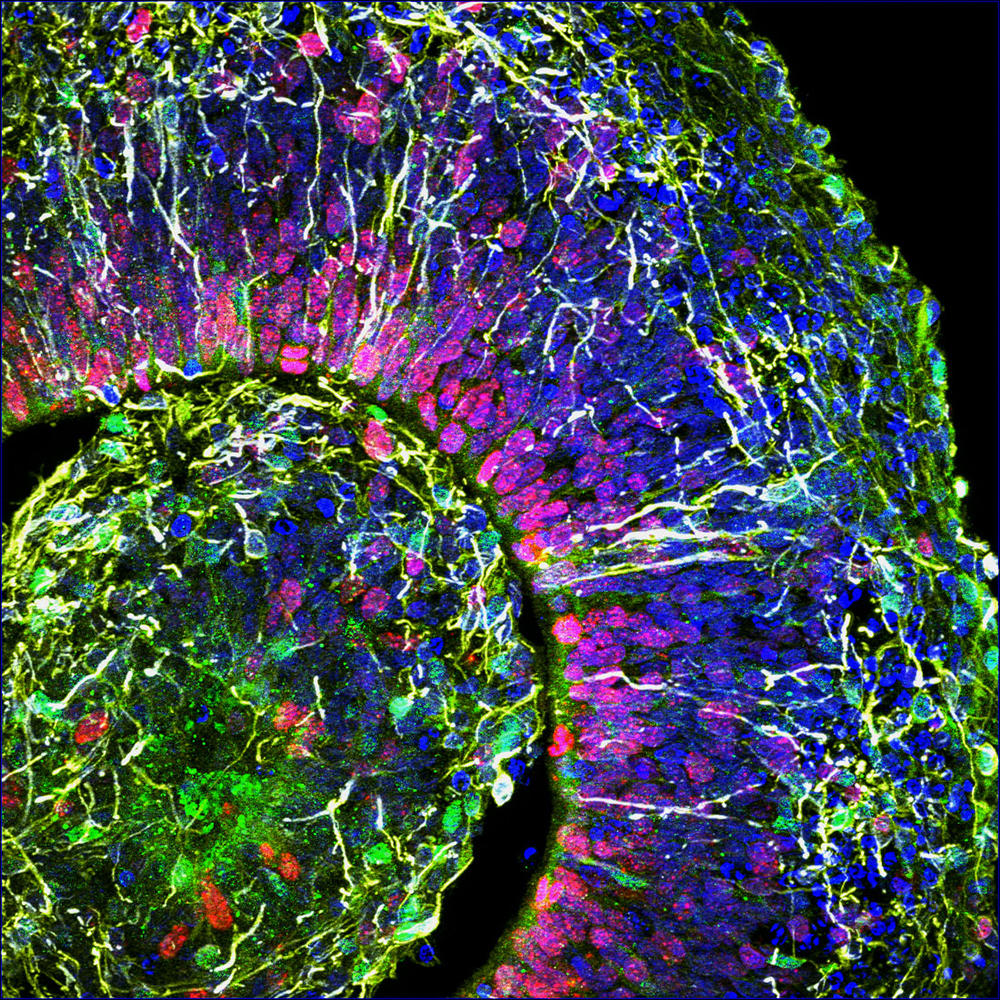
À l’Institut cellule souche et cerveau, à Lyon, le groupe de Bertrand Pain cultive des cérébroïdes. « Par rapport aux modèles animaux qui restituent très mal la complexité du cerveau humain, les organoïdes sont un modèle de choix pour déchiffrer les mécanismes en jeu dans la survenue des troubles du développement cérébral », note le chercheur. Leurs travaux ont déjà permis d’avancer dans la compréhension d’une maladie neurodégénérative héréditaire qui détruit le système nerveux des enfants dès leur plus jeune âge : le syndrome dit « CACH »4, une leucodystrophie qui affecte la myéline, substance blanche enveloppant les nerfs.
Outre les maladies génétiques, les organoïdes cérébraux promettent de nombreux progrès dans la lutte contre les maladies psychiatriques (autisme, dépression...) ou neurologiques (Alzheimer, Parkinson...). Récemment, ces doublures de cerveau ont permis aussi de décrypter le mode d’action du virus Zika qui peut provoquer une insuffisance de la croissance du cerveau, ou microcéphalie, chez les fœtus infectés durant le premier trimestre de grossesse. Et des médicaments antiviraux ont pu ainsi être testés sur les cérébroïdes infectés. Une démarche suivie également par Bertrand Pain, qui s’intéresse aux encéphalopathies (inflammations du cerveau), causées par différents virus, comme celui de la rougeole, en collaboration avec des laboratoires de virologie.
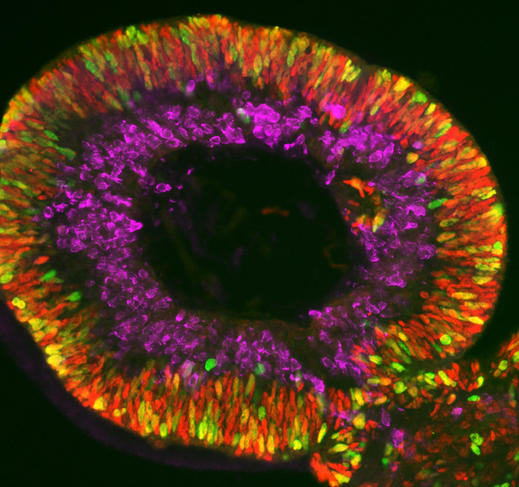
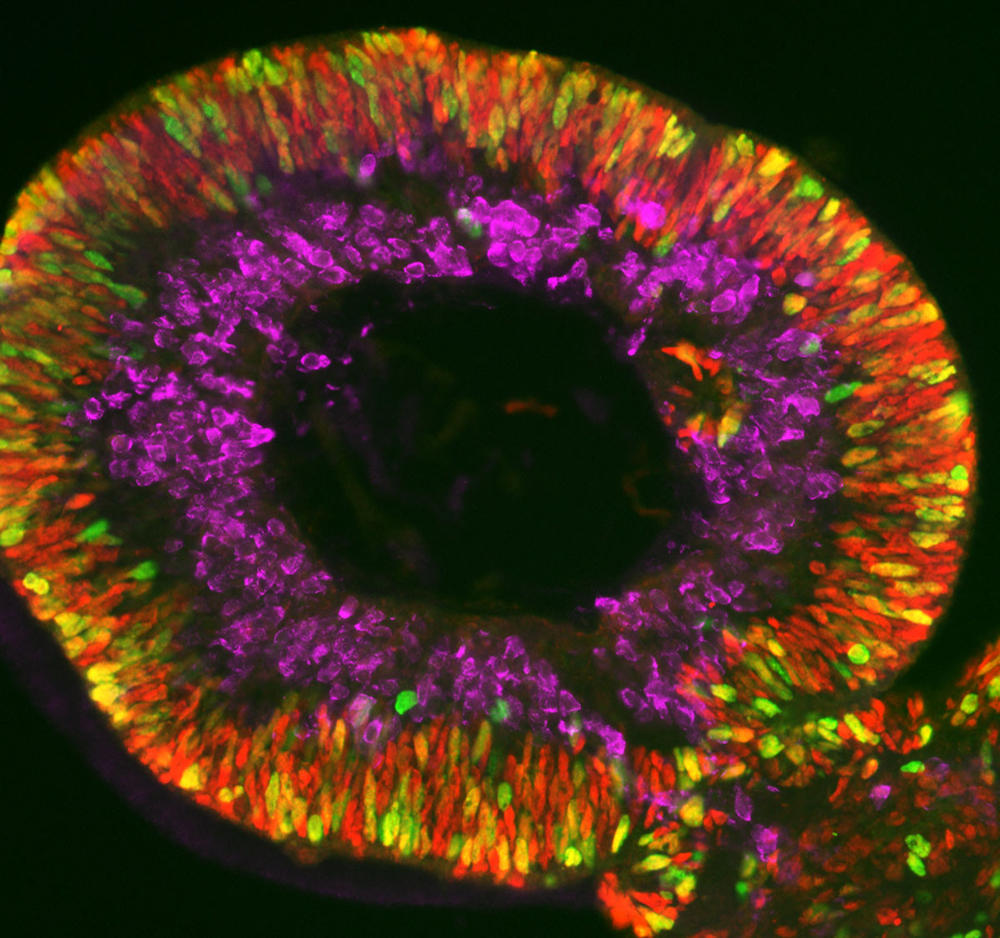
Olivier Goureau et son équipe de l’Institut de la vision5 développent quant à eux des organoïdes de rétine. Leur objet d’étude : les dystrophies rétiniennes, des maladies neurodégénératives, dont certaines génétiques, caractérisées par la perte progressive des photorécepteurs de la rétine (cellules nerveuses spécialisées dans la réception de la lumière) et qui constituent la première cause de cécité dans les pays industrialisés (ailleurs celle-ci est davantage liée à une carence en vitamine A durant l’enfance). Grâce à leurs organoïdes fabriqués à partir de cellules iPS de patients, les biologistes ont pu observer in vitro la mort des photorécepteurs, comme cela se produit chez les malades, et étudier les mécanismes en jeu. Les chercheurs développent maintenant plusieurs approches thérapeutiques qu’ils testent sur leurs mini-organes. Première stratégie : identifier des molécules capables de prévenir la mort de ces cellules.
Réparer la rétine
Autre approche plus prometteuse encore : la thérapie génique. Il s’agit soit d’apporter un gène sain via des virus à ADN dans les cellules, soit d’aller directement corriger les mutations dans l’ADN, notamment par CRISPR-Cas9, les « ciseaux » de la génétique. « Nous avons montré que dans les organoïdes ainsi “réparés’’, les photorécepteurs ne meurent plus. C’est une preuve de concept essentielle pour pouvoir un jour développer un traitement pour les malades », s’enthousiasme le chercheur.
Dernière solution explorée par l’équipe, extrêmement prometteuse elle aussi : la thérapie cellulaire. L’idée est d’utiliser cette fois les organoïdes comme sources de photorécepteurs pour pouvoir les transplanter ensuite dans la rétine de patients aveugles et leur permettre ainsi de recouvrer la vue. « Nous avons fait pour l’instant la démonstration sur des souris : les photorécepteurs que nous avons transplantés leur ont permis de recouvrer partiellement la vue6 », se félicite le biologiste. Cette approche de thérapie cellulaire ne concerne d’ailleurs pas que la rétine, c’est une des grandes applications promises par les organoïdes, tout organe confondu.
.
Cibler les tumeurs cancéreuses
Autre domaine dans lequel on attend beaucoup des mini-organes : la recherche contre le cancer. En effet, de la même manière que l’on fabrique la copie d’un organe, les chercheurs savent aussi créer la réplique d’une tumeur – ou tumoroïde – à partir de cellules souches, dites « tumorales », issues du tissu cancéreux d’un patient. Ces tumoroïdes permettent ainsi de prédire avec justesse la sensibilité des tumeurs aux différents médicaments disponibles. Pour un patient donné, il est alors possible de déterminer la meilleure chimiothérapie avant de lui administrer.
Coûteuse, cette médecine personnalisée est encore réservée à une poignée de patients bénéficiant d’un bon système de prise en charge des soins. Mais elle devrait devenir la norme à l’avenir. D’ores et déjà, des biobanques de tumoroïdes représentatives de la diversité observée chez les patients atteints de différents types de cancers (côlon, pancréas, prostate, poumon, sein, ovaires...) se constituent dans les laboratoires, en France notamment. Avec ces collections, on évalue non seulement l’efficacité de chimiothérapies mais on teste aussi de nouvelles molécules anticancéreuses.
De son côté, Sophie Martin, du Laboratoire de bio-imagerie et pathologies7, développe des tumoroïdes à partir de tissus de patients atteints de cancers de la tête et du cou. « Pour ce type de cancers, la thérapie de base, par anticorps monoclonaux, ne marche que dans 10 à 20 % des cas. Il est donc important de prédire l’éventuel échec de ce traitement pour pouvoir proposer autre chose aux patients », souligne la chercheuse. Mais jusqu’ici, aucun marqueur prédictif de la réponse d’une tumeur à cette thérapie n’avait pu être mis en évidence pour ce genre de cancer. Sophie Martin et son équipe ont pu identifier un tel indicateur : une protéine membranaire présente dans les cellules de la tumeur. « Nous travaillons actuellement à valider ce marqueur dans les tumoroïdes et à tester de nouvelles molécules sur les tumoroïdes qui se montrent résistants au traitement », détaille la biologiste.
Mimer n’est pas remplacer
Dotés d’innombrables vertus, les organoïdes sont promis à un bel avenir. Iront-ils jusqu’à remplacer les modèles animaux et ainsi en finir avec l’expérimentation animale ? « Il ne fait aucun doute que les organoïdes vont permettre de réduire considérablement le recours aux animaux en rendant les tests in vivo plus ciblés. Mais ils ne pourront pas remplacer complètement le modèle animal pour reproduire le fonctionnement d’un organisme dans son ensemble », souligne Bertrand Pain.
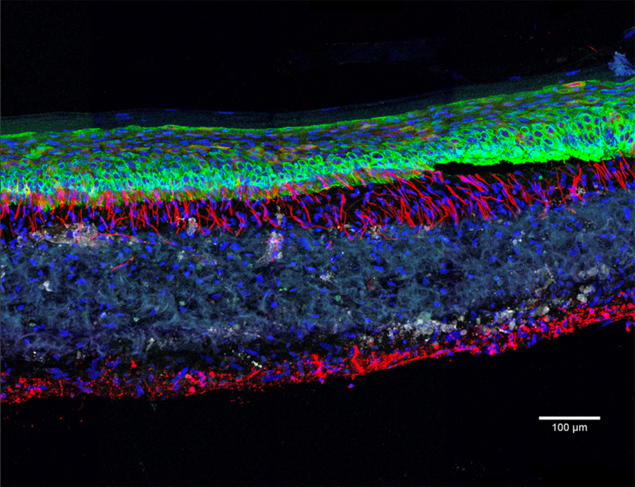

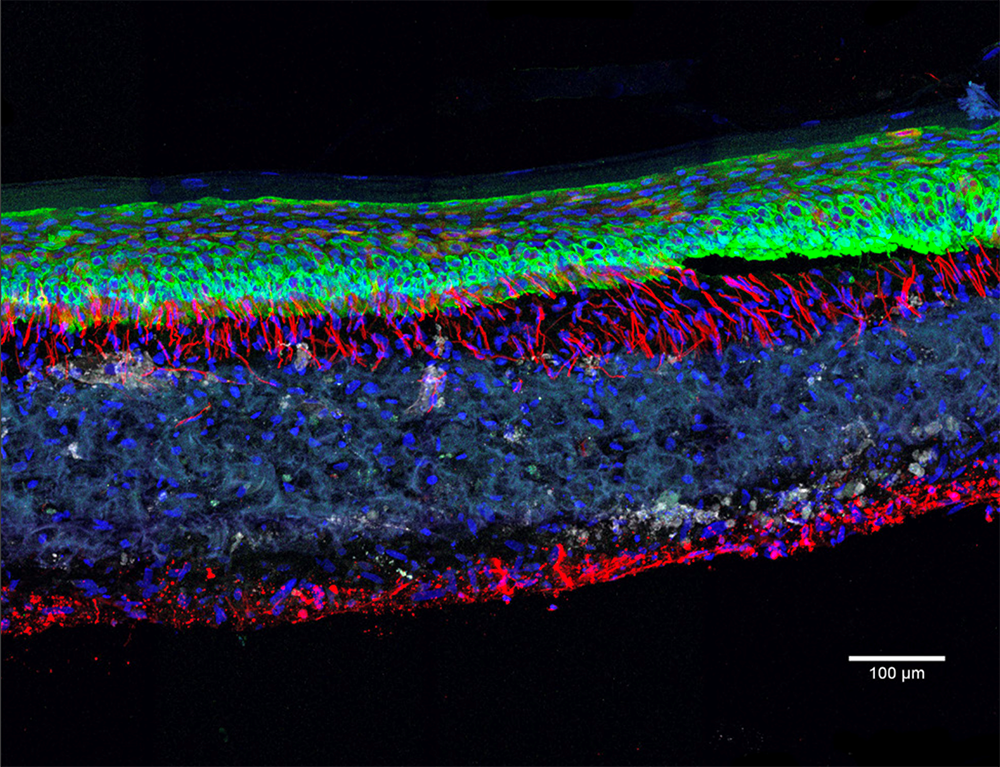
Aussi impressionnants soient-ils, les organoïdes ne sont en effet que des fragments miniatures d’organismes, non inclus dans un tout. Qui plus est, « ces mini-organes sont encore loin de mimer l’ensemble des fonctions de nos organes comme la capacité de détoxification du foie ou les échanges en oxygène pour le poumon », ajoute Jean-Luc Galzi. Autre limite : l’absence dans ces structures de systèmes immunitaire, nerveux ou vasculaire. Dans le cas de la vascularisation, l’obstacle est de taille : sans vaisseaux sanguins pour lui apporter nutriments et oxygène, l’amas de cellules est freiné dans sa croissance et finit souvent par se nécroser de l’intérieur. Quant aux cellules immunitaires et nerveuses, elles sont d’une importance cruciale pour le fonctionnement d’un organe, notamment pour sa réponse à un danger.
Étudier la cicatrisation de la peau
Les biologistes l’ont bien compris et travaillent désormais à intégrer à leurs organoïdes les types cellulaires propres à chacun de ces systèmes. C’est le cas notamment de Vincent Flacher, du laboratoire Immunologie, immunopathologie et chimie thérapeutique du CNRS. Le chercheur développe des structures en 3D qui reproduisent la peau, avec son épiderme et son derme. Pour cela, une matrice de collagène est ensemencée avec des cellules de peau. Puis sont ajoutées successivement des cellules immunitaires – cellules dendritiques, macrophages –, des neurones différenciés à partir de cellules iPS, ou encore des cellules endothéliales dont le réseau imite une vascularisation. « Avec ces modèles de peau réalistes, nous pouvons étudier les interactions entre le système immunitaire et le système nerveux qui jouent un rôle clé dans la cicatrisation, dans les maladies inflammatoires, comme le psoriasis ou la dermatite atopique, et aussi dans les infections virales (Zika, dengue, chikungunya). Et tenter ensuite d’identifier des molécules efficaces contre ces maladies », confie le biologiste.
Implanter un organe de remplacement
Autre approche pour gagner en réalisme : implanter les organoïdes sur puces, des dispositifs microfluidiques qui permettent de « perfuser » les mini-organes via des canaux microscopiques et de mesurer leur activité en temps réel. Avec de tels systèmes, il est désormais possible de connecter entre eux différents organoïdes pour étudier leurs interactions. En France, un projet vise à combiner de cette manière des organoïdes de foie et de rein ou de poumon et de cœur. Avec l’objectif d’évaluer la toxicité de molécules pharmacologiques, une nécessité pour la mise sur le marché de tout nouveau médicament. Et certains imaginent déjà la mise au point un jour d’un véritable body on a chip, c’est-à-dire la reconstitution complète d’un organisme sur puce... À terme, toutes ces prouesses pourraient permettre de réaliser une des grandes promesses offertes par les organoïdes : la possibilité, au-delà de la simple thérapie cellulaire, de reconstituer in vitro un tissu ou un organe fonctionnel pour pouvoir le greffer à un malade.
En attendant, ces mini-organes soulèvent de nombreuses questions. Ainsi, la création de cérébroïdes de plus en plus complexes, faits de la fusion d’organoïdes de régions différentes du cerveau, pourrait ouvrir la voie, selon certains, à l’émergence d’une forme de conscience, que cela soit fait de façon intentionnelle ou non. Pour eux, il convient donc d’agir comme si ces entités sophistiquées étaient capables de « ressentir» et de leur appliquer des règles éthiques (lire encadré plus bas).
Autre interrogation : « Si les organoïdes offrent de nouvelles perspectives dans le domaine de la médecine régénérative, il faudra d’abord en mesurer l’impact pour les patients. Ces organes de synthèse s’étant développés en dehors du corps, sans les interactions naturelles avec les autres organes, ils ont forcément des propriétés différentes. En outre, ils présentent un risque de développer des tumeurs avec le temps », prévient Jean-Luc Galzi. Entre promesses, fantasmes et risques, les organoïdes n’ont pas fini de faire parler d’eux. ♦
----------------------------------------------------------------------
Questions éthiques inédites
Parce qu’ils ne sont pas des entités naturelles mais des répliques de nos organes créées par l’ingénierie biologique à partir de cellules souches, les organoïdes soulèvent des questions éthiques inédites. Constituent-ils de simples objets ? Ou doit-on leur accorder le statut moral de l’entité qu’ils miment ? Concernant les organoïdes « simples » (de foie, de rein, d’intestin...), la réponse est claire : les questions éthiques qu’ils posent touchent – comme pour tout autre matériel biologique humain collecté par un centre de recherche – au consentement éclairé des donneurs de cellules nécessaires à leur production, à la sécurité, l’utilisation ou encore la commercialisation de ces organoïdes.
Mais d’autres organoïdes plus « sophistiqués » méritent en revanche une considération morale sérieuse. Il y a d’abord ce que les biologistes appellent les modèles embryonnaires à usage scientifique, des organoïdes récapitulant les premiers stades du développement embryonnaire. Parmi eux, les blastoïdes ressemblent à s’y méprendre à un embryon, les annexes embryonnaires – les organes contenus dans l’œuf fécondé, extérieurs à l’embryon, qui le nourrissent ou le protègent – étant même présentes. Chez la souris, des expériences ont conduit à la naissance de souriceaux à partir de blastoïdes implantés dans l’utérus d’un animal.
Si une expérience similaire est impensable chez l’humain, « le mimétisme de ces organoïdes avec un embryon est tel qu’il va falloir encadrer leur production. On peut notamment imaginer obliger les biologistes à demander une autorisation pour pouvoir conduire des recherches sur ces blastoïdes », note Hervé Chneiweiss, président du comité d’éthique de l’Institut national de la santé et de la recherche médicale (Inserm) et directeur du laboratoire Neuroscience Paris-Seine8. Même chose avec les organoïdes de cerveau – ou cérébroïdes. Les progrès de ces dernières années laissent entrevoir la possibilité à terme de créer des cérébroïdes complexes, reproduisant la structure complète de notre cerveau, avec ses différentes régions. Obligeant dès lors les scientifiques à se demander si de telles entités pourraient être sensibles à la douleur, voire développer une forme de conscience.
D’ores et déjà, certains éthiciens ont proposé d’agir « comme si » et d’appliquer aux cérébroïdes complexes des règles éthiques inspirées de l’expérimentation animale : n’utiliser ces modèles que si les connaissances potentielles obtenues valent les souffrances éventuellement infligées et minimiser celles-ci, par exemple en administrant des produits anesthésiants. « Cette perspective est de l’ordre du fantasme tant les cérébroïdes actuels sont loin de rivaliser avec la complexité de notre cerveau. Si tant est qu’une telle activité cognitive puisse même exister séparément d’un corps. Reste qu’on ne peut pas ignorer ce questionnement : il faudra à l’avenir mieux réglementer les travaux sur les cérébroïdes et tenter de développer des méthodes pour détecter leur capacité à ressentir. De cette manière seulement, la recherche sur les organoïdes pourra porter ses fruits en toute confiance vis-à-vis du public et en évitant tout fantasme inutile », conclut Hervé Chneiweiss. ♦
- 1. Unité CNRS/ Université Toulouse Paul Sabatier.
- 2. « Cystic fibrosis patient-derived bronchial organoids unveil druggable pathways against Mycobacterium abscessus infection », doi :https://doi.org/10.1101/2022.01.03.474765.
- 3. « Association entre l’utilisation d’antidépresseurs et la réduction du risque d’intubation ou de décès chez les patients hospitalisés atteints de COVID-19 : résultats d’une étude observationnelle », Nicolas Hoertel et al., Psychiatrie moléculaire, n° 26, février 2021.
- 4. Pour Childhood Ataxia with Central Hypomyelination, « ataxie infantile avec hypomyélinisation centrale »
- 5. Unité CNRS/Institut national de la santé et de la recherche médicale/Sorbonne Université.
- 6. « Restoration of visual function by transplantation of optogenetically engineered photoreceptors », Marcela Garita-Hernandez et al., Nat. Commun., octobre 2019 ;10(1):4524.
- 7. Unité CNRS/Université de Strasbourg.
- 8. Unité CNRS/Institut national de la santé et de la recherche médicale/Sorbonne Université.
Mots-clés
Partager cet article
Auteur
Julien Bourdet, né en 1980, est journaliste scientifique indépendant. Il a notamment travaillé pour Le Figaro et pour le magazine d’astronomie Ciel et Espace. Il collabore également régulièrement avec le magazine La Recherche.




































































Commentaires
"La thérapie par cellules
Gulshan oad le 7 Mars 2024 à 13h33Connectez-vous, rejoignez la communauté
du journal CNRS